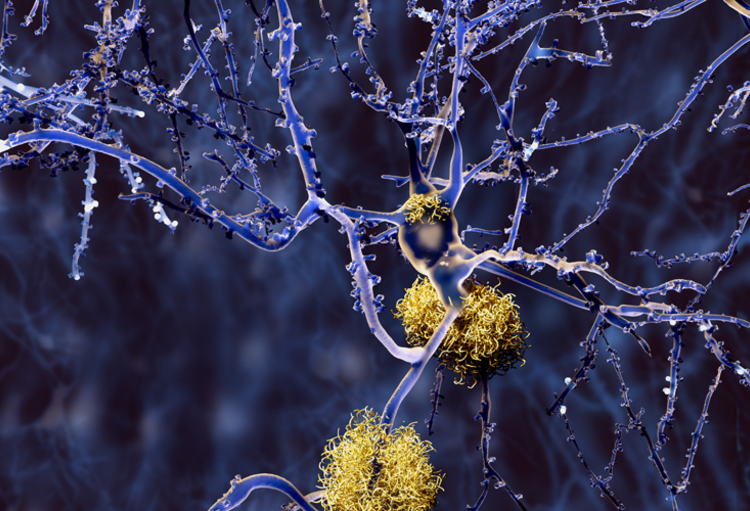
Het Europese geneesmiddelenagentschap EMA heeft het licht op groen gezet voor de eerste behandeling van de ziekte van Alzheimer in de Europese Unie. De behandeling vertraagt de vooruitgang van de ziekte.
De behandeling met de actieve stof lecanemab, die wordt gecommercialiseerd onder de merknaam Leqembi, wordt aanbevolen bij alzheimerpatiënten bij wie de ziekte nog niet in een gevorderd stadium is. Daarnaast geldt de aanbeveling ook enkel voor patiënten met maar één of geen kopie van een specifiek gen (ApoE4). Mensen met twee kopieën lopen een grotere kans op bijwerkingen, zoals zwellingen en bloedingen in de hersenen.
In juli had het Europese geneesmiddelenagentschap de eerste aanvraag tot goedkeuring nog afgewezen. Toen klonk het nog dat de risico's op bijwerkingen te groot waren. Maar het EMA is nu van mening dat voor een specifieke groep patiënten "de voordelen van Leqembi bij het vertragen van de progressie van de ziektesymptomen groter zijn dan de risico's". Patiënten die de behandeling krijgen - een infuus om de twee weken -, moeten wel regelmatig onder de scanner ter controle.
Het is nu aan de Europese Commissie om een definitieve beslissing over de markttoelating voor Leqembi, dat wordt gemaakt door het Japanse farmabedrijf Eisai en het Amerikaanse Biogen. Leqembi is sinds 2023 toegelaten in de Verenigde Staten.
Andere alzheimer-middelen behandelen alleen de symptomen van de ziekte.